四省藥監局聯合發文 新醫械聯盟來了
重磅進展,長三角醫療器械注冊人制度一體化形成。
四省組成,新聯盟形成
10月29日,據江蘇省藥品監督管理局消息,上海、江蘇、浙江、安徽四地藥監局聯合發布《長江三角洲區域醫療器械注冊人制度試點工作實施方案》。

據悉,這次的大舉措是按照國家藥品監督管理局《關于擴大醫療器械注冊人試點工作的通知》的要求來進行,以長江三角洲區域醫療器械產業一體化。
由此可以看出,長三角醫療器械注冊人制度一體化形成。“醫療器械注冊人制度”這一醫療器械行業的創新性的改革,最早從上海試點,后擴大到天津、廣東兩地。
2019年8月,國家藥監局相關通知又明確,北京、天津、河北、遼寧、黑龍江、上海、江蘇、浙江、安徽、福建、山東、廣東等21個省、自治區、直轄市參加醫療器械注冊人制度試點。
怎么聯合?有什么影響?
什么是醫療注冊人制度,經歷了怎樣的變革?
此前,在2014年10月起實施的《醫療器械生產監督管理辦法》中明確規定,拿到醫療器械注冊證才能申請第二類、第三類醫療器械的生產許可證,而取得生產許可才能生產、受托生產相應醫療器械。也即把注冊與生產許可捆綁在一起,必須由一個主體來完成。
現在,醫療器械注冊人制度發生改革,允許企業、機構和人員單獨申請醫療器械注冊證,再以注冊人的身份委托其他企業生產相應的醫療器械。即注冊和生產許可可以不由一個主體來完成。
模式變化:
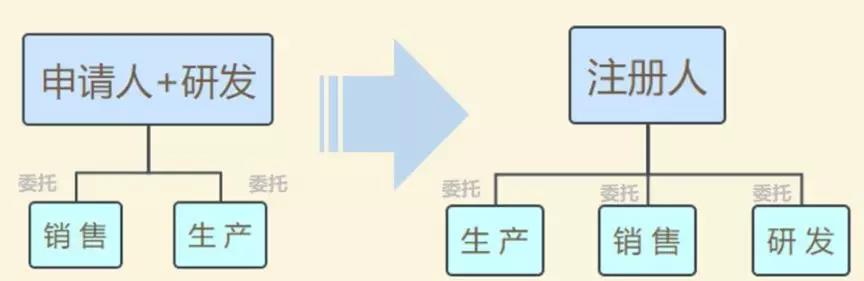
(圖片來源:CFDA法規在線)
“注冊人制度實現了產品注冊和生產許可的解綁,更利于鼓勵創新、整合社會資源、加快醫療器械產品上市”,上海市藥監局醫療器械監管處處長林森勇認為。
多家企業初嘗甜頭
在具體落實上,經國務院批準,行業變局由上海開啟。
2018年2月8日,上海遠心醫療科技有限公司的單道心電記錄儀獲得由上海市藥監部門頒發的第二類醫療器械產品注冊證,成為國內首個享受到醫療器械注冊人制度新政的產品。
持有注冊證的遠心醫療和受托生產的微創電生理都隸屬于上海微創,其由此成為我國醫療器械注冊人制度試點的首個贏家。
上海微創醫療器械有限公司副總裁李勇說,從我們企業試點實踐來看,新政大大節約了研發成本投入。以我們首個獲得試點注冊證的產品為例,節約了1000多萬元研發投入。
嘗到甜頭的上海微創,嘗試力度越來越大。截至目前,該企業已經有7家公司12個產品申請注冊人,其中有2個產品已獲得注冊證。
據悉,除上海微創的2個產品外,上海還有4家企業6個產品在試點過程中獲批。試點形式還出現了擴大生產場地、多點委托,注冊人為科研型企業、醫工互動,非關聯主體跨區域委托、進口產品轉國產化等。
美敦力、邁瑞接連響應
醫療器械注冊人制度可以縮短產品上市周期、提高效率的優勢已經顯現,而且從上海的實踐也能印證,制度改革已經為行業帶來改變,國內醫械龍頭企業也接連“啟航”。
就美敦力來說,與上海微創不同的是,美敦力的委托生產方為捷普科技(上海)有限公司,這是一家專業的第三方代工企業。以其獲批的手術動力系統為例,委托后,該產品獲批上市僅用了45天的時間。
上海市藥監局醫療器械注冊處處長林峰就此表示,該產品原應作為進口產品注冊,但在試點過程中是本地注冊、本地制造,使得本地化轉移成為可能。該產品上市也意味著將來我國會有更多先進醫療器械不再通過進口,而是通過本地注冊、生產,實現快速上市。
多方期待試點范圍擴大
從目前各地實施的結果來看,注冊人制度試點工作取得一定成效,但還存在一定問題。
比如一些企業將注冊人制度簡單理解為委托生產,沒有意識到注冊人要對醫療器械全生命周期的質量管理承擔主體責任;有些企業為享受試點期間的鼓勵政策(如優先審評等),刻意拆分出持證人或受托人;部分持有人和委托人之間產生知識產權糾紛等。
需要看到的是,由于目前試點范圍的局限性,醫療器械注冊人制度雖然不斷釋放紅利,但是速率方面還需加強。
浙江省藥監局有關負責人坦言,資本的逐利性決定其會選擇環境好、成本低的地區進行生產。上海的生產成本相對較高,注冊人完全可到周邊省份去尋找合作伙伴。尤其是在“將長三角區域一體化發展上升為國家戰略”背景下,注冊人試點應拓展到上海周邊省份。
業內人士就此問題談到,在試點過程中,醫療器械注冊人應當具備哪些能力或者條件,應當承擔哪些義務;醫療器械注冊人制度實施會給監管帶來哪些挑戰,這些挑戰如何破解等問題,還需進一步討論與研究,需要在實踐中不斷探索。
來源:賽柏藍器械



